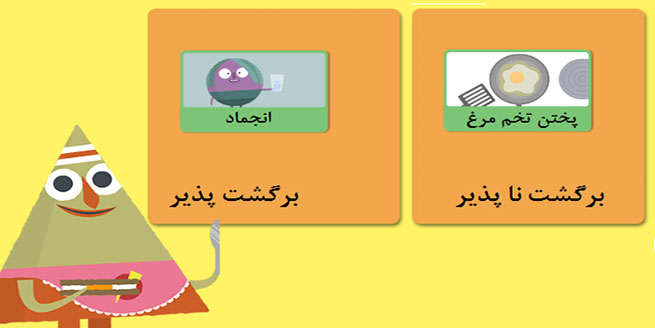
تفاوت فرایندهای برگشت پذیر و برگشت ناپذیر چیست؟
فرایندهای برگشت پذیر و برگشت ناپذیر در شیمی و ترمودینامیک دو مفهوم متفاوت هستند. در واکنش های برگشت پذیر، واکنش ها در هر دو جهت اتفاق می افتند و در نهایت به تعادل می رسند. به عبارت دیگر، محصولات واکنش می توانند با واکنش با یکدیگر دوباره واکنشدهنده ها را به وجود آورند. در واکنش های برگشت ناپذیر، واکنش ها فقط در یک جهت اتفاق می افتند و به تعادل نمی رسند.
برای مثال، در واکنش آمونیاک با اسید کربوکسیلیک، واکنش برگشت پذیر است و می تواند در هر دو جهت اتفاق بیفتد. در واکنش آمونیاک با هیدروکلریک اسید، واکنش برگشت ناپذیر است و فقط در یک جهت اتفاق می افتد.
در ترمودینامیک، تعادل شیمیایی بر پایه غلظت عوامل واکنش و ثابت تعادل K تعیین می شود. اندازهٔ ثابت تعادل وابسته به تغییرات انرژی آزاد گینس در واکن ش است. هنگامی که تغییر انرژی آزاد زیاد باشد، ثابت واکنش بزرگ خواهد بود و غلظت واکنشدهنده ها در تعادل بسیار اندک است. در این حالت، واکنش به عنوان برگشت ناپذیر شناخته می شود، اگرچه بخش کوچکی از واکنشدهنده ها هنوز در سیستم واکنشی وجود دارند. به عنوان مثال، واکنش تشکیل آب از هیدروژن و اکسیژن، به دلیل داشتن تغییر انرژی آزاد بالا، به عنوان واکنش برگشت ناپذیر شناخته می شود.
بنابراین، تفاوت اصلی بین فرایندهای برگشت پذیر و برگشت ناپذیر در این است که در فرایندهای برگشت پذیر، واکنش ها در هر دو جهت اتفاق می افتند و در نهایت به تعادل می رسند، در حالی که در فرایندهای برگشت ناپذیر، واکنش ها فقط در یک جهت اتفاق می افتند و به تعادل نمی رسند. در ترمودینامیک، تعادل شیمیایی بر پایه غلظت عوامل واکنش و ثابت تعادل K ت عیین می شود و اندازهٔ ثابت تعادل وابسته به تغییرات انرژی آزاد گینس در واکنش است. در صورتی که تغییر انرژی آزاد بالا باشد، واکنش به عنوان برگشت ناپذیر شناخته می شود، اگرچه بخش کوچکی از واکنشدهنده ها هنوز در سیستم واکنشی وجود دارند.